EFECTO ANTIESTROGÉNICO
DESINTOXICANTE CELULAR
El sulforafano es un compuesto organosulfurado perteneciente a la familia de los isotiocianatos, por lo que contiene la estructura característica de (–N=C=) como se presenta en la figura 1. Su formula molecular es C6H11NOS2 y es una molécula no muy soluble en agua, termosensible y muy reactiva. Provienen de la hidrolisis de la glucorafanina para producir su aglicona (1-Isotiocianato-4-(metillsulfinil) butano).
Fig. 1 Estructura química de sulforafano (1-Isotiocianato-4-(metillsulfinil)butano)
La ruta biosintética del sulforafano empieza cuando la metionina entra a la maquinaria de elongación de cadena a través de una reacción de transaminación citosolica catalizada por la 4 amino trasferasa de cadena ramificada (BCAT4) que da como resultado el ácido 2-oxo-4-metiltio butanoico el cual se transporta al cloroplasto. El ácido α-keto es conjugado con acetil-CoA por la MAM1 y después isomerisado por una aconitasa y finalmente descarboxilada por una isopropilmalato deshidrogenasa dando como resultado una molécula de ácido 2-oxo-5-metiltio-pentantatonico. Al pasar por otro ciclo de elongación se obtiene el ácido 6-metiltio-2-oxohexanoico el cual es transaminado por la BCAT3 a dihomo-metionina (DHM) como se muestra en la figura 2.
Fig. 2 Elongación de metionina a homo-metionina y/o dihomo-metionina [2]
Después la homometionina (HM) o la DM son convertidos por la CYP79F1 en su correspondiente aldoxima, los cuales son oxidados por la CPY83A1 a una especie reactiva (acinitro). Seguido a esto se lleva acabo una conjugación con glutatión asistido por la GSTF11 se obtiene el ácido S-alkiltiohidroximico y después se libera el tiohidroximato por la acción de la SUR1 + GGP1 el cual es glucosidado por la UGT74C1 formando el desulfoglucosinolato. Para finalizar la enzima AtST5b produce el 3-MTP y la FMO GS-OX1 oxigena la cadena con azufre para producir glucorafanina como se muestra en la figura 3.
Fig. 3 Producción de Glucorafanina a partir de HM o DHM
Bioquímica
El brócoli contiene además otras sustancias bioactivas con propiedades terapéuticas. De todas las verduras, las crucíferas contienen tal vez la variedad más grande de sustancias fotoquímicas con un potencial terapéutico. A continuación un resumen de las más destacadas:
+ Cabagina (S-metilmetionina, también llamada la vitamina U), una sustancia parecida al SAMe con un efecto anti inflamatorio en los epitelios del estómago e intestino.
+ Luteína y otros carotenoides.
+ D-glucarato, que es importante para la glucuronidación, una parte imprescindible para la desintoxicación fase-II.
+ Flavonoides, sobre todo la quercetina y apigenina.
+ Selenio, el brócoli contiene selenio metilado (por ejemplo Se-metilseleno cisteína), que se transforma fácilmente en el anticancerígeno metil selenolato.
+ Hierro, con una biodisponibilidad relativamente alta.
+ Zinc.
+ Vitamina B6 y ácido fólico.
+ Vitamina C, vitamina E y vitamina K.
+ Ácido protocatechu.
+ Ácido clorogénico.
+ Carotenoides.
+ Fibra.
Enfermedades que previene y mecanismo de acción de
Sulforafano
Anticancerígeno: En presencia de sulforafano se llevan acabo varios mecanismos para contrarrestar el riesgo de la carcinogénesis.
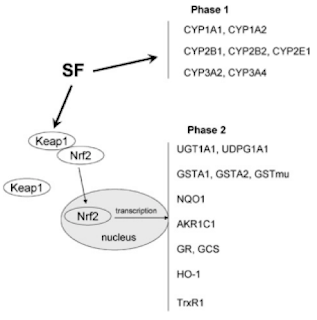
a. Inhibición de Enzimas Fase I y aductos de ADN: Las enzimas fase 1 catalizadas principalmente por las enzimas citocromo P450 hacen que los xenobíoticos sean mas hidrofílicos que como consecuencia los procarcinogenos se convierten en intermediarios muy reactivos. Sulforafano inhibe los aductos de ADN y carcinogénesis química a través de la alteración del nivel de ciertas isoformas de las enzimas P450.
Fig. 4 Inactivación de enzimas fase I e inducción de enzimas fase II por SF. [3]
b. Induce enzimas detoxificantes fase II: Las enzimas Fase II inactivan a los procarcinógenos y los prepara para su excreción. Sulforafano induce la transcripción de quinina reductasa, glutatión-S-transferasa y UDP-glucoronosiltransferasa entre otras. Es un mecanismo tiempo-dosis dependiente, en donde después de que el SF entre al citoplasma se une al complejo Keap1 – Nrf2 causando cambios conformacionales y liberando el Nrf2 que se transloca al núcleo y se une al ARE (elemento de respuesta antioxidante) que activan la producción de enzimas Fase II y genes antioxidantes.
c. Estrés oxidativo: Sulforafano es un agente antioxidante indirecto por lo cual potencia el poder anti oxidativo de la célula. Una de las formas es la inducción de enzimas Fase II que tienen potencial antioxidativo por medio del mecanismo Nrf2. También es un potente activador de la enzima HO-1 que degrada grupos hemos en biliverdina que gradualmente es degradada enzimáticamente a bilirrubina. Además incrementa la producción de glutatión y de enzimas como enzimas como la glutatión transferasa.
d. Apoptosis mediada por sulforafano: El sulforafano media la apoptosis de células cancerígenas al activar la ruta mitocondrial apoptotica, esto involucra la liberación del citocromo c de la mitocondira al citosol el cual se une al factor de activación de apoptosis por proteasas – 1(Apaf-1) que activa el iniciador de la caspasa 9. También se ha encontrado que el sulforafano activa la ruta de receptores intrínsecos de muerte celular la cual es iniciada cuando los ligando de apoptosis como el Fas-L, TRAIL o el factor de necrosis de tumor (TNF-α) activan la cascada intracelular de la maquinaria apoptotica la cual involucra la activación de las caspasa-8 y el subsecuente efecto de las caspasas. Otro efecto es el de la activación de la caspasa-12 que daña el retículo endoplasmico. En el caso de la mitocondria, sulforafano afecta la membrana mitocondrial liberando proteínas como smac/DIABLO que bloquean a los miembros de la familia inhibidora de apoptosis (IAP). Otro mecanismo encontrado es el cual el sulforafano activa los miembros pro-apoptotica de la familia Bcl-2 como lo son Bax y Bak que activan la liberación de citocromo c y smac/DIABLO.
Fig. 5. Rutas activadas por SF para inducir apoptosis [3]
e. Regulación del ciclo celular: Uno de los mecanismos del sulforafano contra el cáncer es detener el ciclo celular en algunas de sus diferentes etapas. Esto se logra por medio de la regulación de las ciclinas y las quinasas dependientes de ciclinas (CDK), en el caso de las etapas G0/G1 se regula la expresión de la ciclina D1 y se reduce los niveles de quinasa cdk4, esto se asoció de la fosforilación de la proteína supresora de tumores Rb que activa la transición de G1 a S. También se detienen la transición de G2/M al regular la expresión de la ciclina B1y al mantener la quinasa cdc2 en su forma activa desfosforilada. Finalmente la fase S se detuvo gracias a la reducción de los niveles de la ciclina A.
Fig. 6 Regulación del ciclo celular por SF sobre las ciclinas y CDK
f. Modulación de la inflamación: Sulforafano regula la transcripción de iNOS mediado por los niveles de liposacaridos, la expresión de Cox-2 y la secreción de TNF-α. El mediador principal es el factor nuclear kB (NF-kB) con el cual interactua el sulforafano con los grupos tiol, el cual puede simplemente desactivarlo por la interacción con residuos de cisteínas esenciales o al interactuar con reguladores redox como Trx y Ref-1 relevantes para la función de NF-kB. Se encontró datos que sugieren que también al inhibir la secreción del high-mobility groupbox 1 (HMGB1).
g. Inhibición de angiogénesis y metástasis: El sulforafano ha demostrado tener efectos inhibitorios del factor de crecimiento vascular endotelial (VEGF) hipoxia inducidos el cual el efecto es tiempo-dosis dependiente. Además de inhibir VEGF, se inhibió los niveles del receptor KDR/flk-1. También afecta la integridad de la membrana de la matriz de colágeno endotelial predominante metaloproteinasa-2 y si inhibidor de tejido de la metaloproteinasa 2. En el caso de metástasis, ya que es un proceso de varios pasos que dependen de la matriz base de la membrana, al inhibir la activación de las metaloproteinas, el sulforafano inhibe los pasos de la metástasis.
Extracción de sulforafano de plantas
Las plantas se mantienen a -20°C, después de homogenizan con agua fría por 2 minutos a 40°C. Se liofilizan y se guarda a -20°C. Se resuspenden en acetonitrilo a 40°C y se hace una microfiltración con 0.45µm con filtros resistente al solvente orgánico y se evapora el solvente en una centrifuga al vació o en un evaporador rotatorio.
Las plantas se mantienen a -20°C, después de homogenizan con agua fría por 2 minutos a 40°C. Se liofilizan y se guarda a -20°C. Se resuspenden en acetonitrilo a 40°C y se hace una microfiltración con 0.45µm con filtros resistente al solvente orgánico y se evapora el solvente en una centrifuga al vació o en un evaporador rotatorio.
Ensayo de potencial de inducción
La actividad se mide en células Hepa1c1c7 en platos de 96. Se deja crecer las células por 24 horas y se inducen por 48 horas con varias diluciones de la muestra. La concentración final del solvente debe ser de 0.2%. Se mide la actividad de la QR basada en la formación del tinte reducido de tetrazolium el cual cambia de azul a café y se mide en un escáner óptico de microplatos utilizando lisados de las células. En un segundo plato se determina la densidad utilizando cristal violeta. Se obtiene información cuantitativa de la actividad especifica de QR, el potencial de inducción, citotoxicidad
La actividad se mide en células Hepa1c1c7 en platos de 96. Se deja crecer las células por 24 horas y se inducen por 48 horas con varias diluciones de la muestra. La concentración final del solvente debe ser de 0.2%. Se mide la actividad de la QR basada en la formación del tinte reducido de tetrazolium el cual cambia de azul a café y se mide en un escáner óptico de microplatos utilizando lisados de las células. En un segundo plato se determina la densidad utilizando cristal violeta. Se obtiene información cuantitativa de la actividad especifica de QR, el potencial de inducción, citotoxicidad
HPLC
Se utiliza HPLC de fase reversa con una columna C18 y se analizan a 215 nm. La fase móvil es una combinación de agua con tetrahidrofuran (95:5) (v/v) con un flujo de 1 ml por minuto. Sulforafano tiene un tiempo de elusión de 25.8 minutos.
Se utiliza HPLC de fase reversa con una columna C18 y se analizan a 215 nm. La fase móvil es una combinación de agua con tetrahidrofuran (95:5) (v/v) con un flujo de 1 ml por minuto. Sulforafano tiene un tiempo de elusión de 25.8 minutos.
Absorción
Con la masticación se liberan los glucosinolatos que se encuentran en los alimentos junto con las mirosinasas las cuales liberan el glucósido por medio de hidrolisis formando los isotiosianatos. Estos son altamente absorbidos en el yeyuno por difusión pasiva y se han encontrado remanentes de sulforafano conjugado con glutatión en el lumen. Si no se llegara a presenta la hidrolisis durante la masticación los glucosinolatos pasan el tracto digestivo hasta llegar al intestino grueso donde son hidrolizados por las mirosinasas producidas por la microflora.
Distribución
Después de que el sulforafano es absorbido en el yeyuno, este es transportado al torrente sanguíneo a otros tejidos por la proteína de transporte MRP1 y MRP2, la cual transporta el sulforafano y sus conjugados a través del cuerpo sobre todo al hígado y a los riñones.
Metabolismo:
Los sulforafano son metabolizados por la ruta del ácido mercapturico el cual involucra una conjugación inicial con glutatión catalizado por la glutatión transferasa, seguido del rompimiento del residuo γ-glutamil por la γ-glutamiltransferasa, después se elimina el residuo de glicina por la citeinilglicinasa y finalmente una N-acetilación para dar conjugados de N-acetilcisteina.
Excreción:
El sulforafano después de ser metabolizado es excretado por la orina mayormente. Una pequeña cantidad de sulforafano conjugado es excretado a través de la bilis.
No se han encontrado efectos toxicológicos en humanos con el consumo de altas cantidades de extractos de crucíferas.
Estudios preclínicos
Carcinógeno o predisposición genética
|
Especie
|
Órgano
| |
Sulforafano
|
4-(Metilnitrosoamino)-1-(3-piridil)-1-butanona
|
Rata Sprague-Dawley
|
Glándulas mamarias
|
Benzo pireno
|
Ratón ICR/Ha
|
Estomago
| |
Azoxymethano
|
rata Fischer
|
Colon
| |
N-Nitroso-bis(2-oxopropil)amina
|
Hamster Sirian
|
Páncreas
| |
NNK y benzopireno
|
Ratón A/J
|
Pulmón
| |
4-(Metilnitrosoamino)-1-(3-piridil)-1-butanona y 1-Isotiocianato-(4R)-(metillsulfinil)butano
|
Ratón SkH-1
|
Piel
| |
Antígeno T SV40
|
Ratón TRAMP
|
Próstata
| |
apc truncation
|
Ratón Apc
|
Intestino delgado
|
Estudios Clínicos
Tipo de estudio
|
Población de estudio
|
Dosis y preparación
|
Seguridad y farmacocinética
| ||
Metabolismo y excreción
|
Voluntarios Sanos en la universidad de John Hopkins
|
Dosis de 200µmol de glucosinolatos o hasta 75µmol de isotiosianatos
|
Voluntarios sanos en la universidad de Nottingham
|
Dosis única de 16 o 52 µmol de isotiocianatos
| |
Voluntarios sanos llevado acabo por la fundación de la salud americana
|
475µmol de glucosinolatos con y sin mirosinasa activa en dos dosis orales ingeridas en el desayuno y en la comida.
| |
Voluntarios sanos llevado acabo en la universidad de Illinois
|
Dosis única de 70 o 120µ de glucosinolatos con y sin la mirosinasa activa
| |
Voluntarios sanos en la universidad estatal de Oregon
|
Dosis única de 221µml o 161µmol de glucosinolatos.
| |
Voluntarios Sanos en hospital de He Zuo
|
Dosis orales diarias de 800µmol de glucorafanina o 150µmol de sulforafano por 7 días.
| |
Eficiencia
| ||
Inducción de enzimas citoprotectoras en piel
|
Voluntarios Sanos (Hopkins)
|
Dosis únicas o múltiples 3 veces con 24 horas de diferencia hasta 200µmol de isotiosianatos aplicados tópicamente
|
Inducción de enzimas citoprotectoras en cavidades nasales
|
Voluntarios sanos (UCLA)
|
3 dosis oraes con 24 horas de diferencia hasta 102µmol de isotiocianatos
|
Inducción de enzimas citoprotectoras en PBMCs
|
Voluntarios sanos(Hopkins)
|
Dosis diarias de 100µM de isotiociantos por 2 semanas
|
Inducción de enzimas citoprotectoras en plasma
|
Voluntarios sanos (Fred Hutchinson)
|
Suplementación dietaría de 7 a 14 gr de crucíferas por kilo de peso corporal por 2 semanas.
|
Inhibición de HDAC en PBMCs
|
Voluntarios Sanos (Oregon)
|
Dosis única de 68 gr de germinado de brócoli
|
Inhibición de la actividad de la MIF tautomerasa urinaria
|
Voluntarios sanos (Hopkins)
|
Dosis única oral de 200µmon del glucosinolatos
|
Reducción de eritema causada por irradiación UVB
|
Voluntarios sanos (Hopkins)
|
Dosis múltiples separadas por 24 horas de 200µmol de isotiocianatos aplicados tópicamente a 2 cm de diámetro en la piel.
|
Disminución de niveles urinarios de aductos de aflotoxina-ADN y fenantreno tretraols
|
Voluntarios Sanos (He Zuo)
|
Dosis nocturnas de 400µmol de glucosinolatos por 2 semanas
|
Incremento de la excreción urinaria de conjugados derivados de glutatión de contaminantes aéreos.
|
Voluntarios Sanos (He Zuo)
|
Dosis diarias de 800µmol de glucosinolatos o de 150 µmol de isotiocianatos por 7 días
|
Cambios en el receptor TGFβ, EGFR, rutas de señalización de insulina en tejido prostático
|
Hombres con altos niveles de neoplasia prostática (Norfolk y Norwich)
|
Glucosinolatos (400 g por semana de brócoli cocido) por 1 año
|
Para la producción biotecnológica se utilizo el modelo genéticamente modificado de la planta de tabaco (Nicotiana benthamiana) y que produzca glucorafanina. Para ello se tuvo que diseñar la maquinaria de elongación de cadena usando casetes de expresión multigenica en los cuales los genes fueron expresados por un solo promotor, el 35S. Esto se logro generando mRNA polisistronico con múltiples codificaciones de secuencias separados por una secuencia viral 2A autoprocesante la cual causa un salto transduccional del ribosoma que ayuda a liberar a la cadena de polipéptidos. Esto permitió la expresión simultánea de 3 secuencias que fueron traducidas a proteínas individuales. Esta maquinaria fue unida a la secuencia blanco de la subunidad de rubisco del cloroplasto cpBCAT4. La transfección se llevo acabo por medio de Agrobacterium tumefaciens.
Esta en investigación y desarrollo la producción biotecnologíca de glucorafanina, precursor del sulforafano, en levadura. Este proyecto se esta desarrollando con el fin de producir grandes cantidades de glucosinolatos con efecto anticancerígeno.
Fig. 8 Diagrama de la producción biotecnológica.
*
Dosis Terapéuticas
No conocemos el consumo diario adecuado de sulforafano (si hay alguno). Recomendaciones típicas varían de 200 a 400 mcg diariamente.
Enlaces de interés: